Endoparasiten bei Hunden und Katzen
Endoparasiten sind Spezialisten, wenn es darum geht, durch komplizierte Entwicklungszyklen ihr Weiterleben zu garantieren oder sich den unterschiedlichsten Wirten anzupassen. Häufig gehört zu diesen „Wirten“ auch der Mensch!
Vielen Endoparasiten von Hunden und Katzen sind Zoonose Erreger. Angesichts des engen Zusammenlebens gerade von Hunden und Katzen mit dem Menschen spielen daher Bekämpfungs- und Vorbeugemaßnahmen eine besondere Rolle.
Besiedelt ein Parasit das Körperinnere, z.B. Blutzelle oder Körperorgane wie das Herz, die Harnblase, die Lunge oder den Darm, so nennt man ihn Endoparasit (von griechisch éndon: "innen").
Hunde und Katzen haben in unserer Gesellschaft vielfach den Status eines Familienmitgliedeserreicht. Sie haben Zugang zu allen Wohnräumen – bis hin zum Schlafzimmer. Insbesondere für viele Katzen und Zwerghunde ist sogar das Bett nicht tabu! Dieser enge Kontakt kann für den Menschen potentiell gefährlich werden: Wurmeier, die im Fell der Tiere kleben können, werden so schnell versehentlich verschluckt. Tierhalter sind oft unzureichend über diese Problematik informiert und vernachlässigen daher entsprechende Vorsorgemaßnahmen.
Wenn wir bisher in Deutschland von „Wurmbefall bei Hunden und Katzen“ gesprochen haben, so bezogen wir uns auf die im Darm lebenden Rund- und Bandwürmer.
Neue Studien zeigen: Hier ist ein Umdenken unbedingt erforderlich!
Zusätzlich zu den altbekannten Band-, Spul-, Haken- und Peitschenwürmern im Darm müssen neuerdings bei der Diagnose von Erkrankungen auch folgende Würmer in Betracht gezogen werden:
- Lungenwürmer kommen bei Hunden in Deutschland häufiger vor und sind regional weiter verbreitet als bislang angenommen.
- Importhunde aus dem Süden Europas und Hunde nach einer Urlaubsreise werden zunehmend mit einer Herzwurminfektion in deutschen Kleintierpraxen vorgestellt.
- Erste Fälle von in der Haut lebenden Würmern (Dirofilaria repens) sind bei Hunden in Deutschland aufgetreten.
Alte, eingefahrene Wurmbekämpfungsstrategien müssen neu überdacht und der veränderten Situation angepasst werden.
Wurmarten und Infektionswege
Endoparasiten sind nicht nur an ihre Wirtstiere gebunden, sondern auch an klimatische Bedingungen. Das erklärt das ursprünglich unterschiedliche Vorkommen in den einzelnen Ländern Europas und natürlich auch weltweit.
Bei Hund und Katze entstammen parasitische Würmer (Helminthen) den folgenden Kategorien:
- Stamm Plathelmintha (Plattwürmer)
- Überklasse Trematoda (Saugwürmer)
- Klasse Cestodea (Bandwürmer)
- Stamm Nemathelmintha (Schlauchwürmer)
- Klasse Nematodea (Rundwürmer)
Infektionswege: Wie kommt der Wurm ins Tier?
Direkte orale Infektion
Durch Beschnuppern von Kot oder Wühlen in der Erde gelangen Wurmeier oder Wurmlarven an die Nase und werden abgeleckt und abgeschluckt.
Merke: Wurmeier brauchen abhängig von der Umgebungstemperatur mehrere Tage in der Außenwelt um zu „sporulieren“ und damit infektiös zu werden. Nicht der frisch abgesetzte, sondern der mehrere Tage alte Kot ist gefährlich!

(Direkte orale Infektion)
Orale Infektion durch Zwischenwirt oder paratenischen Wirt
Als Zwischenwirt (ZW) bezeichnet man einen Organismus, der Jugendstadien eines Parasiten in sich aufnimmt und diese nach ihrer Vermehrung oder Weiterentwicklung an einen neuen Wirt (z.B. Hund oder Katze) überträgt.
Die Art der Zwischenwirte (Flöhe, Mäuse, Schnecken, Fische, u.a.) ist für die jeweilige Wurmart spezifisch.
Ein paratenischer Wirt (PW)ist dagegen ein Organismus, der einen Parasiten nur mechanisch überträgt, ohne dass sich dieser vermehrt oder wandelt.
Der Infektionsweg über Zwischenwirt spielt besonders bei Bandwürmern eine Rolle. Auch die Infektion mit Lungenwürmern(gehören zu den Rundwürmern) und mit Saugwürmernerfolgt durch den Verzehr von Zwischenwirten.

(Orale Infektion über Zwischenwirt (Floh)
Perkutane Infektion
Hakenwurmlarven können aktiv durch die gesunde Haut von Hund und Katze eindringen.

(Perkutane Infektion)
Infektion durch Blutsauger
Während des Blutmahls können verschiedene Arten von Stechmücken infektiöse Filarienlarven (Dirofilaria immitis, Dirofilaria repens) übertragen.

(Infektion_durch_Blutsauger)
Intrauterine Infektion
Toxocara canis Larven werden bereits intrauterin mit dem Blut über die Plazenta auf den Fetus übertragen. (Dieser Infektionsweg ist nur für Spulwurmlarven beim Hund nachgewiesen.)
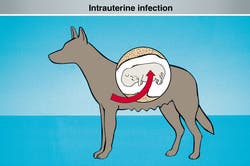
(Intrauterine Infektion)
Galaktogene Infektion
Infektiöse Larven wandern aus der Muskulatur in die Gesäugeleiste des Muttertieres. Die Jungtiere infizieren sich bei der Milchaufnahme. Hundewelpen können sich auf diese Weise mit Spul- und Hakenwurmlarven infizieren, Katzenwelpen nur mit Spulwurmlarven.
Ruhestadien von Wurmlarven in der Muskulatur werden bei einer Trächtigkeit nicht aufgebraucht. Bis zu drei aufeinander folgende Würfe eines Muttertieres können ohne Reinfektion (erneuter Befall mit Würmern) infiziert werden. Siehe hierzu später die Erklärung unter Hypobiose.

(Laktogene Infektion)
Bandwürmer
Zestoden oder Bandwürmer verdanken ihren Namen der flachen, bandartigen Körperform. Die Würmer parasitieren im Dünndarm der Endwirte. Je nach Art können sie eine Länge von mehreren Metern erreichen (der Rinderfinnenbandwurm des Menschen zum Beispiel bis zu 10m!), und sie können mehrere Jahre alt werden.
Aufbau
Kopfteil (Skolex)
Der Skolex dient dem Wurm zur Verankerung in der Darmschleimhaut. Mit – je nach Bandwurmspezies – typischen Hakenkränzen oder Saugnäpfen haftet er sich an und verhindert so eine frühzeitige Elimination durch die Darmperistaltik oder den passierenden Nahrungsbrei.

(Skolex Taenia taeniaeformis)
Halsbereich
Im unsegmentierten Halsbereich werden ständig neue Glieder (Proglottiden) produziert. Hier ist die Wachstumsstelle des Bandwurms.

(Proglottiden Taenia spp.)
Gliederkette
In ihrer Gesamtheit bilden die Proglottiden die Gliederkette oder Strobila.

(Segment von Dipylidium caninum im Darm einer Katze)
Die Nahrungsaufnahme erfolgt bei Bandwürmern über die Körperoberfläche (Integument).
Achtung! Genau an dieser Stelle wirken die meisten Bandwurmpräparate (Praziquantel). Sie schädigen das Integument und verhindern damit eine weitere Ernährung. Der Bandwurm „verhungert“ einerseits. Gleichzeitig wird durch die Schädigung die Bandwurmoberfläche angreifbar für die Verdauungssäfte. Der Bandwurm wird andererseits „verdaut“.
Lebenszyklus
Nahezu alle Bandwurmarten sind Zwitter. Das bedeutet, jede Proglottide enthält ein vollständig ausgebildetes männliches und weibliches Geschlechtssystem.
Am Ende der Strobila befinden sich die „reifen“ Bandwurmglieder. „Reif“ bedeutet, sie enthalten Eier und zwar je nach Art 15. 000 bis 100. 000.
Diese reifen Glieder werden vom Bandwurm abgestoßen und sind zunächst beweglich. Sie können daher auch außerhalb des Kotabsatzes aus dem After wandern (Juckreiz!, „Schlittenfahren“!) Sie bleiben entweder zunächst im Fell der Tiere hängen oder fallen in die Umgebung.
Nach einiger Zeit trocknet die schützende Hülle ein und zerfällt. Somit werden die Eier freigesetzt.
Für die weitere Entwicklung ist jetzt die Aufnahme der Eier durch einen so genannten Zwischenwirt (Maus, Floh) erforderlich. Hier entsteht das „Finnenstadium“.
Diese „Finne“, die bereits die Anlage des Bandwurmkopfes (Skolex) enthält, wird mit dem Zwischenwirt vom Endwirt (Hund, Katze) aufgenommen. In dessen Darmtrakt wird der Bandwurmkopf ausgestülpt. Er haftet sich an der Darmschleimhaut fest, und der Wurm reift zum erwachsenen Bandwurm heran. Diese Reifungszeit, auch als Präpatenzzeit bezeichnet, beträgt im Durchschnitt bei den relevanten Bandwurmarten für Hunde und Katzen in Europa 4 Wochen.
Zusammenfassung (s. Zyklusbild):
1. Die Endwirte sind Karnivoren (Fleischfresser). Sie beherbergen die ca. 45cm langen Bandwürmer im Dünndarm.
2. Sie scheiden gurken- oder kürbiskernähnliche (daher der Name!) Proglottiden aus.
3. Die getrockneten Bandwurmglieder enthalten Pakete mit jeweils bis zu 40 Eiern.
4. Diese werden von Flohlarven aufgenommen, in denen sich das Finnenstadium entwickelt.
5. Hunde und Katzen infizieren sich durch das Herunterschlucken von infizierten Flöhen.

(Eipakete von Dipylidium caninum)

(Lebenszyklus von Dipylidium caninum)
Gurkenkernbandwurm (Dipylidium caninum)
Der am häufigsten vorkommende Bandwurm bei Hund und Katze ist der durch Flöhe übertragene Kürbiskernbandwurm (Dipylidium caninum).
- Länge des ausgewachsenen Parasiten: bis zu 50 cm
- Größe des Eipakets: 120-200 µm
- Größe des Eis: 25-40 x 30-45 µm
- Larvale Form wird als Cysticerkoid bezeichnet.

(Dipylidium caninum)
Dickhalsiger Bandwurm (Taenia taeniaeformis)
Eine bei Katzen oft vertretene Bandwurmart ist Taenia taeniaeformis. Besonders gefährdet sind Katzen mit Freilauf, denn als Überträger fungieren Beutetiere wie Mäuse, Ratten oder andere Kleinnager. Die Finnenstadien sitzen bei diesen Zwischenwirten in der Leber. Derart befallene Kleinsäuger sind entsprechend „leberkrank“ und daher nicht mehr ganz so flink: Also ganz besonders leichte Beute für die Katze!!!
- Länge des ausgewachsenen Parasiten: bis zu 60 cm
- Größe des Eis: 37 x 32 µm
- Larvale Form wird bezeichnet als Cysticerkus (Strobilozerkus) fasciolaris

(Lebenszyklus Taeniaformis)

(Ei Tania spp.)
Rundwürmer
Nematoden (griech. nema = Faden) sind fadenförmige Würmer.
Die Länge der adulten (ausgewachsenen) Würmer variiert je nach Spezies zwischen 1 Millimeter und 1 Meter. Nematoden sind getrennt geschlechtlich. Männliche Würmer sind meist etwas kleiner als weibliche Würmer.
Die Entwicklung kann je nach Wurmart direkt, obligat über Zwischenwirte oder fakultativ über paratenische Wirte erfolgen.
Wenn wir bisher in Deutschland von „Wurmbefall bei Hunden und Katzen“ gesprochen haben, so bezogen wir uns auf die im Darm lebenden Rund- und Bandwürmer. Neue Studien zeigen: Hier ist ein Umdenken unbedingt erforderlich! Zusätzlich zu den altbekannten Band-, Spul-, Haken- und Peitschenwürmern im Darm müssen neuerdings bei der Diagnose von Erkrankungen auch sogenannte extraintestinale Würmer in Betracht gezogen werden: Fadenwürmer in Herz oder Haut und Lungenwürmer.
Darmrundwürmer
Adulte Toxocara cati im Dünndarm einer Katze

Nematoden (griech. nema = Faden) sind fadenförmige Würmer. Die Länge der adulten (ausgewachsenen) Würmer variiert je nach Spezies zwischen 1 Millimeter und 1 Meter. Nematoden sind getrennt geschlechtlich. Männliche Würmer sind meist etwas kleiner als weibliche Würmer.
Die Entwicklung kann je nach Wurmart direkt, obligat über Zwischenwirte oder fakultativ über paratenische Wirte erfolgen (siehe Entwicklungszyklus).
Zu den Darmrundwürmern gehören als häufigste Vertreter die:
Spulwürmer (Ascaridida)
Spulwürmer sehen aus wie ein Stück Spaghetti, sind bis zu 18cm lang und leben im Dünndarm von Hund und Katze.
- Bei Hunden: Toxocara canis, Toxascaris leonina
- Bei Katzen: Toxocara cati, Toxascaris leonina
Toxascaris leonina

Toxocara cati

Hakenwürmer (Ancylostomatidae):
Hakenwürmer besitzen ein abgebogenes Vorderende mit einer Mundkapsel und sind Blutsauger, Länge: 1-2cm.
- Bei Hunden: Uncinaria stenocephala (in Deutschland), Ancylostoma caninum (in tropischen und subtropischen Gebieten)
- Bei Katzen: Ancylostoma tubaeforme, Uncinaria stenocephala
Ancylostoma caninum

Ancylostoma tubaeforme

Peitschenwürmer (Trichuris):
Peitschenwürmer (Trichuris vulpis) kommen nur bei Hunden vor. An ihrem Wurmkörper kann das lange, dünne Vorderteil, die „Peitschenschnur“, von dem dickeren Hinterteil, dem „Peitschenstiel“ unterschieden werden. Mit dem Vorderteil bohrt sich der Wurm in die Darmschleimhaut und ernährt sich von Blut und Gewebesäften. Er ist ein Dickdarmbewohner Länge: 4-7cm.
Trichuris vulpis

Entwicklungszyklus
Die wichtigsten Rundwürmer von Hund und Katze haben einen direkten Entwicklungszyklus, d.h., dass sie keinen Zwischenwirt benötigen. Die Anzahl der abgegebenen Eier kann sehr groß sein. Ein weiblicher Spulwurm kann pro Tag bis zu 200 000 Eier produzieren!
Mit dem Fleischfresserkot gelangen die Eier in die Umwelt. Dort schlüpfen die Larven, die nach mehrmaliger Häutung infektionsfähig werden. Bei einigen Arten entwickeln sich die Larven im Ei, so dass die Tiere sich mit der Aufnahme von Eiern aus der Umwelt (zum Beispiel durch Herumschnuppern) infizieren können.
Nach der Infektion des Wirtes wird nach weiteren Häutungen das Adultstadium im Tier erreicht. Der Wurm ist ausgewachsen, geschlechtsreif, verpaart sich und beginnt erneut mit der Produktion von Eiern.
Larven wandern während ihrer Reifung häufig durch unterschiedliche Körpergewebe und Organe des Wirtes und schädigen diese dabei (s. Entwicklungszyklen unten).
Hypobiose
Ein besonderes Phänomen bei Spul- und Hakenwürmern ist die Hypobiose – ein Ruhezustand des letzten Larvenstadiums meistens in der Muskulatur der Endwirte.
Diese Ruhelarven spielen eine große Rolle bei der Übertragung von Wurminfektionen vom Muttertier auf die Welpen. Infolge hormoneller Umstellung während der Trächtigkeit kommt es zur Reaktivierung dieser ruhenden Gewebelarven.
Spulwurmlarven wandern um den 40. Trächtigkeitstag bei der Hündin über die Plazenta in die Feten (intrauterine Infektion), wo sie vor allem in der Leber, aber auch im Gehirn, den Nieren, in der Muskulatur und in der Lunge zu finden sind.
Erst nach der Geburt gelangen diese Larven zunächst über den Blutweg und das Herz in den Blutkreislauf der Lunge. Hier wandern sie vom Blut über die Bronchien in die Luftröhre. Sie werden hochgehustet, abgeschluckt und erreichen dann ihr Ziel: den Dünndarm.
Bereits in einem Alter von 3 Wochen scheiden Hundewelpen mit ihrem Kot Spulwurmeier aus! Spul- und Hakenwurmlarven wandern außerdem in die Milchdrüse und werden über die Muttermilch auf die saugenden Welpen übertragen (galaktogene Infektion).
Bei Katzen wurde bisher nur eine Übertragung von Spulwurmlarven mit der Muttermilch nachgewiesen.
Da immer nur ein Teil der Ruhelarven mobilisiert wird, können selbst ohne erneute Infektion mehrere Würfe durch ein Muttertier infiziert werden.
Entwicklungszyklus von Toxocara cati

Entwicklungszyklus Spulwürmer:
1. In ca. 2 Wochen entwickelt sich die infektiöse Larve im Ei.
2. Der Mensch infiziert sich durch versehentliches Verschlucken von infektiösen Eiern.
3. Infektiöse Eier gelangen beim Herumschnuppern an die Nase und werden abgeleckt.
4. Nach dem Schlüpfen durchdringen ein Teil der Larven die Darmwand, gelangen auf dem Blutweg in die Muskulatur und verkapseln sich zu Ruhestadien (Hypobiose).
5. Im letzten Drittel der Trächtigkeit werden die Ruhelarven aktiviert und gelangen via Blut über die Plazenta in die Gebärmutter. Es kommt zur intrauterinen Infektion der Welpen.
6. Aktivierte Ruhelarven wandern auch in das Gesäuge und werden mit der Muttermilch an die Welpen abgegeben (galaktogene Infektion).
7. Ein Teil der Larven entwickelt sich im Dünndarm zu adulten Würmern.
8. Mit dem Kot werden die Eier ausgeschieden.
9. Nach der Geburt erreichen die Larven über das Blut den Lungenkreislauf. Sie dringen in die Bronchien ein und wandern zur Luftröhre.
10. Sie werden hochgehustet und abgeschluckt. Im Dünndarm entwickelt sich der adulte Wurm.
11. Bereits 3 Wochen nach der Geburt scheiden Hundewelpen Spulwurmeier aus.
12. In ca. 2 Wochen entwickelt sich die infektiöse Larve im Ei (siehe 1.).
13. Bei Welpen durchbohren die geschlüpften Larven die Darmwand und gelangen über den Blutkreislauf in die Lunge.
14. Toxascaris entwickelt sich ohne Körperwanderung der Larven direkt im Darm.
Lebenszyklus Ancylostoma tubaeforme

Entwicklungszyklus Hakenwürmer:
1. Die meisten Larven entwickeln sich nach oraler Aufnahme direkt in der Magenwand und gelangen von dort in den Darm. Einige wenige Larven können auch über die Trachealwanderung in den Darm einwandern.
2. Hakenwürmer heften sich an der Darmschleimhaut fest und saugen Blut.
3. Eier gelangen mit den Fäzes ins Freie.
4. Das erste Larvenstadium (L1) entwickelt sich im Ei.
5. Das dritte Larvenstadium ist infektiös.
6. Ein direkter Entwicklungszyklus des Wurms in der Magen-Darmwand des Wirtes findet statt, wenn ein Stapelwirt gefressen wird, der die L3 enthält.
7. Der Mensch infiziert sich durch direkten Hautkontakt mit kontaminiertem Erdboden.
8. Eine perkutane Infektion entsteht durch aktives Eindringen der Larven durch die intakte gesunde Haut.
9. Einige Larven gelangen mit der L3 mit dem Blutstrom in Muskeln und Fettgewebe, in denen sie in einem inaktiven Zustand verbleiben. Die mögliche Reaktivierung dieser Dauerlarven ist nur ungenügend dokumentiert. Eine laktogene Übertragung ist bisher bei Katzen nicht nachgewiesen worden.
10. Die Larven gelangen mit dem Blutstrom in die Lungen und von dort über die Trachea in den Dünndarm. Hier entwickeln sie sich zum adulten Wurm.
11. Hakenwürmer heften sich an der Darmschleimhaut fest und saugen Blut.
Entwicklungszyklus Peitschenwürmer:
Im Vergleich zu Spul- und Hakenwürmern eher einfallslos: der Peitschenwurm des Hundes (Trichuris vulpis).
Die Entwicklung der infektiösen Larve im Ei in der Außenwelt ist stark temperaturabhängig und kann 8 Tage bis mehrere Monate (!) dauern.
Nach dem Abschlucken der infektiösen Eier entwickeln sich die Larven im Darm des Hundes weiter bis zum Adultstadium und besiedeln den Dickdarm. Im Gegensatz zu Spul- und Hakenwürmern findet bei Peitschenwürmern keine Körperwanderung der Larvenstadien statt.
Eine Besonderheit sind die sehr widerstandsfähigen und langlebigen Eier, die nur gegen Austrocknung sehr empfindlich sind. Unter günstigen Bedingungen können sie jahrelang überleben!
Peitschenwürmer treten eher bei erwachsenen Hunden als bei Junghunden auf. Auch bei Füchsen kommen sie häufig vor.
Extraintestinale Rundwürmer
Nematoden außerhalb des Darms
Zusätzlich zu den altbekannten Band-, Spul-, Haken- und Peitschenwürmern im Darm müssen neuerdings bei der Diagnose von Erkrankungen auch folgende Würmer in Betracht gezogen werden:
- Lungenwürmer kommen bei Hunden in Deutschland häufiger vor und sind regional weiter verbreitet, als bislang angenommen.
- Importhunde aus dem Süden Europas und Hunde nach einer Urlaubsreise werden zunehmend mit einer Herzwurminfektion in deutschen Kleintierpraxen vorgestellt.
- Erste Fälle von in der Haut lebenden Würmern (Dirofilaria repens) sind bei Hunden in Deutschland aufgetreten.
Fadenwürmer (Filarien)
Dirofilaria immitis

Filarien sind fadenförmige Würmer, die beim Blutmahl von Stechmücken (verschiedene Arten, zum Beispiel Culex, Anopheles und Aedes) übertragen werden. Adulte Würmer werden auch als „Makrofilarien“ bezeichnet. Weibliche Makrofilarien sind „ovovivipar“, das heißt, sie produzieren keine Eier wie zum Beispiel Spulwürmer, sondern mit einer Eihülle umgebene Larven, die „Mikrofilarien“. Diese Mikrofilarien gelangen je nach Befallstärke zu Tausenden in den Blutkreislauf, wo sie mehrere Jahre überleben können. Mit dem Blutmahl werden sie von Stechmücken (= Zwischenwirte) aufgenommen. Hier findet die Weiterentwicklung zur infektiösen Larve statt. Die Dauer der Entwicklung ist dabei abhängig von der Umgebungstemperatur.
Beim nächsten Blutmahl der Mücke gelangt die Larve in den nächsten Endwirt.
In der Kleintierpraxis relevant sind Dirofilaria immitis, der Herzwurm und Dirofilaria repens, eine vorzugsweise in der Haut lebende Fadenwurmart.
Dirofilaria immitis
Adulte Herzwürmer (Makrofilarien) leben in den großen Lungenarterien, der rechten Herzkammer und Herzvorkammer und bei einem starken Befall auch in der caudalen Körperhohlvene, Vena cava caudalis. Herzwürmer werden 30 - 40cm lang und sind etwa 1mm dick. Sie leben durchschnittlich 7 Jahre, Einzelexemplare erreichen aber mitunter auch ein Lebensalter von 13 – 15 Jahren!
Nach der Infektion durch den Stich einer blutsaugenden Mücke dauert es etwa 70 Tage bis die Herzwurmlarve die Lungenarterien erreicht und weitere 6 Monate bis sie geschlechtsreif wird und mit der Produktion von Mikrofilarien beginnt. Hunde, Katzen und andere Carnivoren gelten als Endwirte.
Für die Entwicklung der Larven in der Mücke sind relativ hohe Umgebungstemperaturen erforderlich, die bisher in Deutschland nicht beständig erreicht werden. Daher besteht derzeit in Deutschland keine Gefahr für Hunde und Katzen sich mit Herzwürmern zu infizieren.
Viele Länder Süd- und Osteuropa`s gelten als Endemiegebiete. Der weiterhin zunehmende Import von Hunden aus diesen Ländern sowie die zunehmende Zahl der Reise begleitenden Hunde lässt die Frequenz der Erkrankungsfälle auch in Deutschland ansteigen.
Dirofilaria immitis

Lebenszyklus Herzwurm

Mikrofilarien D. immiti

Dirofilaria repens
Dieser kommt ebenfalls vorzugsweise in Südeuropa vor. Allerdings gibt es in jüngster Zeit Hinweise, dass es auch zu Infektionen in Deutschland kommen kann. Erste Fallbeschreibungen liegen bereits vor.
Makrofilarien leben vornehmlich in den tiefen Hautschichten, können aber auch in anderen Organen auftreten. Nach einer Infektion durch eine Stechmücke dauert es zwischen 25 und 34 Wochen bis Mikrofilarien im Blut auftreten (=Präpatenzzeit).
Hautfilariose (Mensch)

Lungenwürmer
Lungenwürmer bei Hunden, insbesondere Angiostrongylus vasorum und Crenosoma vulpis, wurden in der Vergangenheit immer wieder in bestimmten Regionen Deutschlands sporadisch gefunden.
Angiostrongylus vasorum
Angiostrongylus vasorum ist von besonderer Bedeutung, da er zu schweren klinischen Erscheinungen bis hin zu Todesfällen führen kann.
In Süddeutschland konnten bei Hunden mit Lungensymptomen eine unerwartet hohe Befallrate mit Lungenwürmern nachgewiesen werden. Aktuelle Laborstudien sollen nun zeigen, wie weit sich dieser Parasit in Deutschland ausgebreitet hat. Weitere Länder, in denen der Lungenwurm des Hundes zu Hause ist, sind England, Frankreich, Ungarn, Dänemark und die Schweiz.
Außer bei Hunden kommt diese Rundwurmart auch bei Füchsen vor, die auch für das ansteigende Vorkommen verantwortlich gemacht werden.
Umgangssprachlich wird der Parasit häufig auch als „Französischer Herzwurm“ bezeichnet: Ähnlich wie Dirofilaria immitis lebt er in den Pulmonalarterien und im rechten Herzen. Das ist aber auch alles, was er mit dem Herzwurm gemeinsam hat!
Er erreicht nur eine Länge von 18-25mm, und seine Übertragung erfolgt über Schnecken (=Zwischenwirt).
Weibliche Lungenwürmer produzieren Eier, die sich in Kapillargefäßen der Lunge stauen. Die sich daraus entwickelnden Larven dringen in die Lungenalveolen ein, werden hochgehustet, abgeschluckt und mit dem Kot ausgeschieden. Befallene Hunde scheiden zum Teil bis zu 280 000 Larven pro Gramm Kot aus! Die Präpatenz beträgt 28 bis 108 Tage. Die Würmer erreichen durchschnittlich ein Alter von 5 Jahren.
Angiostrongylus vasorum

Lebenszyklus Angiostrongylus vasorum

Crenosoma vulpis
Crenosoma vulpis – auch „Fuchslungenwurm“ aufgrund des hauptsächlichen Endwirtes genannt - rückt ebenfalls immer mehr in den Fokus der deutschen Tierärzte.
Der Wurm befällt die Bronchiolen, Bronchien und Trachea von wilden und domestizierten Caniden. Die klinischen Symptome ähneln allergischen Respirationserkrankungen.
Zu einer erhöhten Befallzahl bei Hunden scheinen sowohl eine verbesserte Erkennung als auch eine gesteigerte Urbanisierung der Füchse zu führen.
Crenosoma vulpis

Lebenszyklus Crenosoma vulpis

Der Befall mit Lungenwürmern ist zwar schwer diagnostizierbar, aber dafür umso leichter behandelbar.
Im Magen:
Spirocerca-Arten (Hund)
Die Würmer leben aufgerollt in derben Knoten in der Schleimhaut der Speiseröhre, des Magens und der Aorta. Larvenhaltige Eier werden mit dem Kot ausgeschieden.
Infektionsweg: orale Aufnahme der Eier.
Ollulanus – Arten (Katze)
Adulte leben in der Magenschleimhaut.
Infektionsweg: orale Aufnahme von erbrochenem Mageninhalt
Weitere Rundwürmer
Die folgenden Wurmexemplare kommen eher selten vor und können nach ihrer Lokalisation eingeteilt werden:
In der Nase:
Linguatula serrata = Zungenwürmer (Hund)
Erwachsene Zungenwürmer leben in den Nasenhöhlen oder im Respirationstrakt. Die Eier gelangen mit dem Nasenschleim ins Freie und werden dort von Pflanzenfressern aufgenommen.
Infektionswege: nasal beim Aufschnüffeln freier Larven oder oral durch infizierte Eingeweide von Pflanzenfressern.
In der Blase:
Capillaria-Arten (Hund, Katze)
Adulte leben eingebettet in der Schleimhaut der Blase, des Nierenbeckens und der Harnleiter.
Infektionsweg: orale Aufnahme von Eiern oder Zwischenwirten.
Im Bindehautsack des Auges:
Augenwurm, Thelazia callipaeda (Hund, Katze, Mensch)
Endemiegebiete: Italien, Südschweiz, Frankreich
Infektionsweg: Übertragung durch Fruchtfliegen
Gefahr für den Mensch
Gefahr für den Mensch Hunde und Katzen haben in unserer Gesellschaft vielfach den Status eines Familienmitgliedes [strong] erreicht. Sie haben Zugang zu allen Wohnräumen – bis hin zum Schlafzimmer. Insbesondere für viele Katzen und Zwerghunde ist sogar das Bett nicht tabu! Dieser enge Kontakt kann für den Menschen potentiell gefährlich werden.
Es gibt verschiedene Wege, über die sich der Mensch bei seinem Haustier infizieren kann:
Orale Infektion
In der überwiegenden Zahl der Fälle infiziert sich der Mensch durch die orale Aufnahme von Wurmeiern.
Infizierte Hunde und Katzen scheiden mit ihrem Kot Wurmeier oft in großer Anzahl aus und stellen damit eine ständige Infektionsgefahr dar.
Bei engem Kontakt über das Fell, durch Ablecken von Händen, Gesicht und Speisen, durch den Genuss ungewaschener Waldfrüchte, Salat oder Gemüse, durch Kot verunreinigte Sandkästen oder Badestrände können diese Wurmeier in den Mund des Menschen gelangen.
Perkutane Infektion
Beim direkten Hautkontakt mit kontaminierten Sandkästen, an feuchtwarmen Badestränden oder auf Liegewiesen können Hakenwurmlarven aktiv in die menschliche Haut eindringen.
Aerogene Infektion
Es wird vermutet, dass die Eier des kleinen Fuchsbandwurmes auch eingeatmet werden können, insbesondere bei Arbeiten im Garten, auf dem Feld oder im Wald.
Infektion über Stechmücken
Stechmücken können beim Blutsaugen Fadenwürmer auch auf den Menschen übertragen. Die möglichen Gesundheitsschäden beim Menschen durch zoonotische Wurminfektion sind variabel und z.T. dramatisch. Zur Veranschaulichung sind hier einige mögliche Zoonoseschäden durch Würmer aufgeführt:
Schäden durch Dipylidium caninum
Dies kommt nur in Ausnahmefällen vor, kann aber passieren, wenn vor allem Babys und Kleinkinder von Hunden oder Katzen beleckt werden, die gerade einen Floh (= Zwischenwirt!!!) zerbissen haben, oder wenn sie durch engen Kontakt versehentlich Flohteile, die im Fell kleben, verschlucken.
Im Dünndarm des Menschen entwickelt sich dann der etwa 50cm lange Bandwurm. Bauchschmerzen, Durchfälle, Gewichtsverlust und Juckreiz am After durch die auswandernden Proglottiden können auftreten.
Schäden durch Echinococcus-Arten
- Echinococcus granulosus (kleiner Hundebandwurm):
Dieser Bandwurm kommt in Deutschland zwar nicht mehr vor, allerdings treten immer wieder einige Fälle beim Menschen auf. Wahrscheinlich haben sich diese Personen im Urlaub durch die Aufnahme von mit Bandwurmeiern kontaminierten Nahrungsmitteln (Obst, Salat, Gemüse) infiziert. Die sich aus diesen Eiern entwickelnde Finne verursacht mit Flüssigkeit gefüllte Zysten in verschiedenen Körperorganen, die eine operative Entfernung erfordern.
Die Erkrankung wird als „Zystische Echinococcose“ oder „Hydatitose“ bezeichnet.
- Echinococcus multilocularis (kleiner Fuchsbandwurm)
Die Infektion mit Eiern des Fuchsbandwurms kann zur so genannten „Alveolären Echinococcose“ führen, die als Europa`s gefährlichste Wurmzoonose gilt.
Die Bandwurmfinne verhält sich im Menschen aufgrund ihres ungehemmten, infiltrativen Wachstums wie ein bösartiger Tumor. In ca. 98% ist primär die Leber betroffen, sekundär können aber auch „Metastasen“ besonders in Lunge und Gehirn entstehen.
Der Verlauf ist schleichend, erste Symptome (Übelkeit, Oberbauchschmerzen, Gelbsucht) treten durchschnittlich erst 10 – 15 Jahre nach der Infektion auf.
Fortschritte in Diagnostik und Therapie haben im Vergleich zu früher die Prognose für erkrankte Menschen deutlich verbessert. Allerdings ist der Therapieaufwand immer noch hoch und erfordert meist eine lebenslange Medikation.
Schäden durch Toxocara-Arten
Die als „Larva migrans“ bekannte Erkrankung des Menschen wird durch Larven des Hunde- bzw. Katzenspulwurms hervorgerufen.
Nach versehentlichem Abschlucken von Wurmeiern schlüpfen im oberen Teil des Dünndarms Larven, die durch die Darmwand hindurch wandern und ähnlich wie bei Hund und Katze über Blut und Lymphe in Gewebe und Organe geschwemmt werden.
Bei gesunden, erwachsenen Personen reagiert das Immunsystem und stoppt diese Larven, in dem es ein Granulom darum bildet. Die Larve stirbt nach etwa 2-3 Wochen ab.
Bei Kindern, bei denen das Immunsystem noch nicht ausgereift ist oder bei Personen, deren körpereigene Abwehr nicht funktioniert (geschwächte Menschen, HIV – Patienten, Transplantatpatienten, u.a.) können diese Larven zum Beispiel in der Leber oder im ZNS zu erheblichen Schäden mit gravierenden Gesundheitsfolgen führen.
Im Frühjahr 2006 wurde in diversen Fachzeitschriften der Fall eines siebenjährigen Mädchens veröffentlicht, bei dem sich infolge eines Spulwurmbefalls eine tumorartige Geschwulst im Gehirn gebildet hatte. Das Mädchen litt unter epileptiformen Anfällen und Lähmungserscheinungen. Der „Tumor“ musste operativ entfernt werden. In seinem Zentrum befand sich eine Spulwurmlarve.
Zielorgan dieser Larven ist in vielen Fällen auch das Auge „Larva migrans ocularis“. Hier kommt es zu massiven Entzündungen und oft zu einem Verlust der Sehfähigkeit.
In jüngster Zeit häufen sich Veröffentlichungen, die eine ursächliche Beteiligung von Spulwurminfektionen bei allergischen und asthmatischen Erkrankungen in Betracht ziehen.
In Europa sind ca. 3 -7% der Bevölkerung auf Toxocara seropositiv (ca. 30% der Beschäftigten in tierärztlichen Praxen!!!).
Schäden durch Hakenwürmer
Bei der „Larva migrans cutanea“ handelt es sich um eine, durch wandernde Nematodenlarven hervorgerufene, Dermatitis (Hautentzündung).
Häufigste Erreger sind in Deutschland die Larven von Uncinaria stenocephala und in den Tropen und Subtropen Larven von Ancylostoma caninum.
Hakenwurmlarven können bei Kontakt auch in die menschliche Haut eindringen.
Häufigste Infektionsquellen sind feuchtwarmer Sand oder Erdböden, die direkt durch Kot infizierter Hunde oder Katzen oder indirekt über Abwasser oder Jauche mit Entwicklungsstadien von Hakenwürmern kontaminiert sind. Besonders infektionsgefährdet sind Kinder, die sich in Sandkästen, Spielplätzen oder auf Rasenflächen aufhalten. Auch Badestrände können eine Infektionsquelle darstellen.
An der Einwanderungsstelle entstehen 2 – 4 Tage nach der Infektion rötliche, stark juckende Hautläsionen. Sekundäre bakterielle Besiedelung kann zu eitrigen Ekzemen führen. Die Larven wandern in der Haut und rufen mit diesen Bohrgängen die typischen Hautveränderungen hervor, die auch als „Hautmaulwurf“ bezeichnet werden.
Schäden durch Filarien
Über infizierte Stechmücken können auch die Larven von Filarien auf den Menschen übertragen werden.
Larven von Dirofilaria immitis verursachen kleine Granulomherde in der Lunge. Die Infektion verläuft generell subklinisch, d.h., es kommt zu keinen Krankheitssymptomen.
Larven von Dirofilaria repens, dem Hautfadenwurm hingegen können zu Hautveränderungen beim Menschen führen. Dokumentiert sind Fälle dieser Fadenwürmer in der Bindehaut des Auges. Die Behandlung ist operativ.
Nachweisverfahren
Die in der Praxis üblichen Labormethoden zur Diagnosestellung eines Wurmbefalls sind die Kot- und die Blutuntersuchung. Sie können allerdings nur als Unterstützung zur Diagnosefindung dienen. Bei der Kotuntersuchung gibt es folgende Möglichkeiten:
Nativpräparat
Bei hochgradigem Parasitenbefall.
Beim Nativpräparat wird eine kleine Menge Kot mit etwas Wasser suspendiert, auf einem Objektträger ausgestrichen und direkt unter dem Mikroskop bei Lupenvergrößerung untersucht. Nur ein positiver Befund ist aussagekräftig und deutet auf eine hochgradige Verwurmung hin.
Flotationsverfahren
Bei Rund- und Bandwürmern.
Das Flotationsverfahren wird in 4 Schritten durchgeführt:
1. Kotprobe in einer Flotationslösung verrühren.
2. Durch ein Haarsieb in ein Zentrifugenglas (15ml) gießen.
3. Zentrifugieren für 3 – 5 Minuten bei etwa 1000 – 1500 U/min.
4. Mit einer Drahtöse direkt einige Tropfen von der Oberfläche der zentrifugierten Lösung abnehmen auf einen Objektträger bringen und unter dem Mikroskop untersuchen.
oder
Zentrifugenglas nach der Zentrifugation mit Flotationslösung soweit auffüllen, dass ein Meniskus entsteht. Darauf setzt man vorsichtig ein Deckglas und belässt dieses für einige Minuten. In dieser Zeit flotieren vorhandene Wurmeier an die Unterfläche des Deckglases. Das Deckglas wird abgenommen, auf einen Objektträger gelegt und das Präparat unter dem Mikroskop durchgemustert.
Beispiele für Flotationslösungen:
Als Flotationslösungen werden spezifische, gesättigte Salzlösungen verwendet, deren spezifisches Gewicht durch den Salzgehalt höher ist als das der Wurmeier. Folge: Wurmeier flotieren an die Oberfläche der Flüssigkeit
- Gesättigte Kochsalzlösung: 340g Kochsalz (NaCl) pro 1000ml Wasser
- Zinkchlorid – Kochsalzlösung: 275g Zinkchlorid (ZnCl2) + 262g Kochsalz (NaCl) pro 1000 Wasser
Auch kommerzielle Schnelltests (z.B. Ovassay, Fecalyzer) zur Durchführung einer Flotationsuntersuchung sind auf dem Markt. Sie sind sehr einfach zu handhaben, sauber in der Durchführung und bestechen durch ihre Anwenderfreundlichkeit.
Generell muss aber mit einer geringeren Nachweissicherheit im Vergleich zu klassischen Flotationsverfahren gerechnet werden.
Auswanderverfahren
Bei Lungenwürmern:
Lungenwurmlarven können auch mittels des Flotationsverfahrens nachgewiesen werden, allerdings wird ihre Struktur durch die Salzlösungen meist geschädigt, weshalb dem so genannten Larvenauswanderungverfahrens nach Baermann den Vorzug gegeben wird. Hier ist es wichtig, frischen Kot zu untersuchen, da ansonsten auch andere Rundwurmlarven vorgefunden werden können.
Als Baermann-Apparat dient ein Glas – oder Haushaltstrichter, der an einem Stativ befestigt ist. Am Trichterausgang wird ein ca. 10cm langer Gummischlauch aufgesteckt und zunächst mit einer Klemme verschlossen.
Die frische Kotprobe (ca. 20g) wird in ein mit Gaze ausgelegtes feinmaschiges (Tee-) Sieb verbracht und in den Trichter gehängt. Das ganze System wird nun mit lauwarmem Wasser aufgefüllt, so dass die Kotprobe vollständig bedeckt ist.
In der folgenden Ruhephase von 12- 24 Stunden wandern die Larven aus dem Kot in die Flüssigkeit und sammeln sich – da sie schwerer sind als Wasser – oberhalb der Klemme an.
Nach dem Lösen der Klemme werden direkt die ersten Flüssigkeitstropfen aufgefangen und ohne Deckglas bei schwacher Vergrößerung mikroskopisch untersucht.
Die beweglichen Larven sind sehr gut sichtbar.
Tipp: Diese Untersuchungsmethode kann man im Herbst gut mit frischem Igelkot üben. Hier findet man sehr häufig Lungenwurmlarven!
Sedimentationsverfahren
Bei Saugwürmern:
Das Sedimentationsverfahren spielt vorwiegend in der Großtierpraxis eine Rolle zum Beispiel zur Diagnose eines Leberegelbefalls. Deswegen wird hier nicht näher darauf eingegangen.
Bei der Blutuntersuchung gibt es folgende Möglichkeiten:
Direkt-Nachweis
EDTA – Blut mit physiologischer Kochsalzlösung verdünnen und direkt unter dem Mikroskop untersuchen (gelingt nur bei hochgradigem Befall und damit hoher Filariendichte im Blut).
Antigen-Nachweis
Nur bei Dirofilaria immitis.
Herzwürmer können sehr einfach und spezifisch mit einem kommerziellen Testkit (Snap 3Dx ELISA - Praxisschnelltest) nachgewiesen werden. Der Test reagiert auf ein Antigen im Blut, das im Geschlechtssystem eines weiblichen Herzwurmes produziert wird.
Der Nachweis gelingt frühestens 5 Monate nach einer Infektion.
Infektionen mit weniger als 3 Würmern oder Befall ausschließlich mit männlichen Würmern (kommt häufiger bei Katzen vor) bleiben mit diesem Test unentdeckt.
Nachweis von Mikrofilarien
Unspezifisch, bei allen Filarien möglich.
Mikrofilarien können frühestens 6 Monate nach einer Infektion nachgewiesen werden.
Die Konzentration von Mikrofilarien im Blut unterliegt einem tageszeitlichen Rhythmus. Sie ist besonders hoch am späten Nachmittag und Abend (entspricht der Flugzeit von Stechmücken: biologische Anpassung von Vektor und Parasit!).
Daher sollte auch die Blutprobe, wenn möglich abends genommen werden.
Anreicherung mit modifiziertem Knott-Test
1ml EDTA - Blut wird mit 5ml 2%iger Formalinlösung vorsichtig vermischt. Dadurch werden die Erythrozyten zerstört und die Mikrofilarien fixiert.
Nach 3 Minuten Ruhezeit 5 Minuten bei 1300 U /min zentrifugieren und den Überstand abkippen.
Dem verbliebenen Sediment 1 Tropfen Methylen – Blau 0,1% zufügen. Dadurch werden die Mikrofilarien angefärbt. Nach einer Wartezeit von 3 Minuten verbringt man einen Tropfen auf einen Objekträger, deckt das Präparat mit einem Deckglas ab und untersucht bei 4 – 10facher Vergrößerung.
Mit diesen Methoden können Filarienarten nicht unterschieden werden. Eine anschließende Differenzierung in einem Untersuchungslabor zum Beispiel mit einer PCR – Untersuchung ist erforderlich.
